Investigadores del Instituto de Fisiología Celular (IFC) desarrollaron un estudio de frontera que permite visualizar la importancia de cambios genéticos que conllevan a la desorganización del genoma y aberración en la expresión de genes que pueden causar enfermedades como el cáncer.
Una de las contribuciones relevantes de este trabajo, publicado en la revista Nature Communications, es revelar cómo se desorganiza el gen Notch, considerado clave en el desarrollo de neuronas en todos los organismos, desde los gusanos hasta el humano. Este gen también es uno de los que presenta más mutaciones durante el desarrollo de la leucemia, el cáncer en la sangre.
La investigación, precursora en México, muestra que disociar la estructura tridimensional de dicho gen tiene un efecto inmediato en el prendido y apagado del mismo gen Notch y otros genes aledaños.
La correcta expresión de los genes en el espacio y el tiempo es indispensable para el correcto desarrollo y vida de un organismo, pero las fallas en el control de ese proceso lleva a malformaciones y a problemas como el cáncer, afirmó Félix Recillas Targa, uno de los científicos que participó en el estudio, junto con Mayra Furlan Magaril, Rodrigo Arzate-Mejía, Ángel Josué Cerecedo-Castillo y Georgina Guerrero.
Recillas Targa destacó que “este trabajo de frontera está hecho con recursos mexicanos, en un laboratorio de la Universidad Nacional, y con estudiantes apoyados en posgrados de la misma institución”.

Desestabilización genética
En su indagación, los universitarios utilizaron líneas celulares de embriones de la mosca de la fruta (Drosophila melanogaster), en las que desestabilizaron la arquitectura del gen Notch, para después medir su expresión. Este proceso representaba una apuesta “porque no sabíamos si se generaría un cambio en la expresión y en qué dirección ocurriría. Al editar genéticamente la arquitectura del gen Notch afectamos la expresión del mismo y, a su vez, lo anterior repercutió en lo que hay arriba y abajo, es decir, ocurrió un efecto dominó”, detalló Arzate-Mejía.
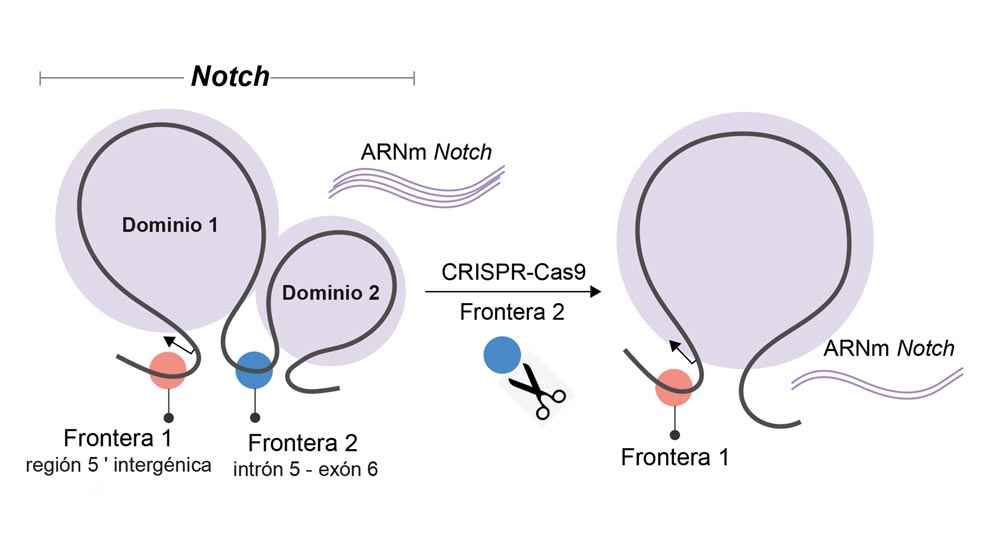
El estudiante de doctorado aclaró que el gen Notch se encuentra organizado en dos dominios o TADs (Topologically Associating Domains), dominios asociados topológicamente, es decir, que las secuencias de ADN dentro de un TAD interactúan físicamente entre sí con mayor frecuencia que con secuencias fuera de TAD.
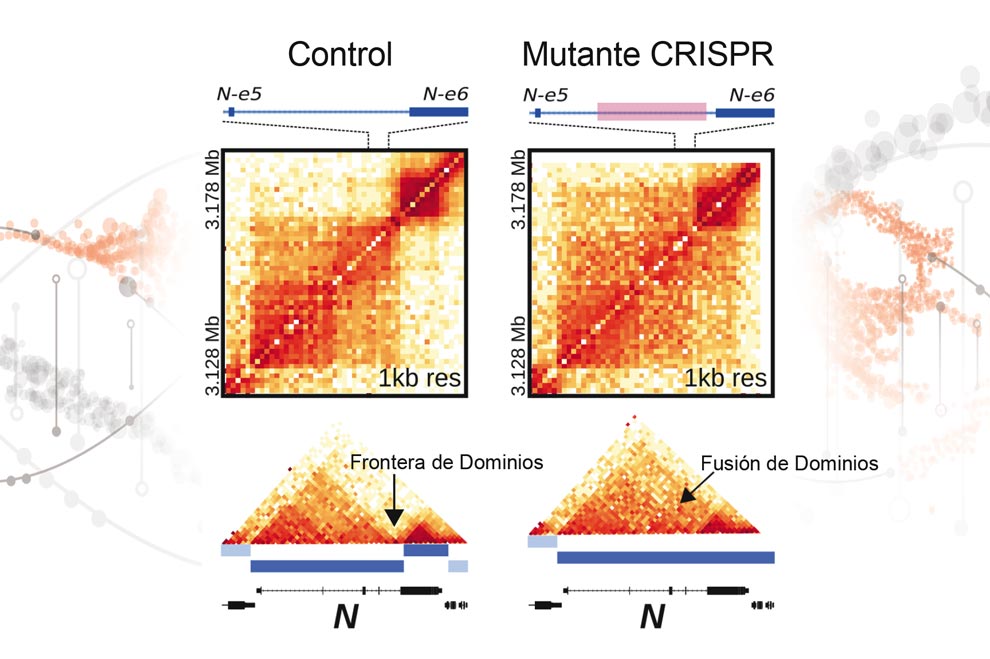
“Manipulamos genéticamente las fronteras de los TADs de Notch mediante el sistema CRISPR de edición genética –que son como tijeras moleculares de gran precisión–, y logramos definir cómo estas secuencias ayudan a estructurar el genoma en TAD y conocer su impacto en la regulación de los genes”, dijo.
Para entender el proceso, los expertos ejemplificaron que la cadena de ADN se puede visualizar como un conjunto de departamentos en un edificio; Notch es uno de ellos, y al tumbar un fragmento de la pared que representa a la frontera entre TADs, ocurre un efecto dominó: se dan interacciones con otros departamentos no sólo vecinos, sino alejados a Notch, generando alteraciones en cascada en la célula.
Conocimiento para el mundo
Por mucho tiempo se pensó que la distribución del genoma al interior del núcleo celular no era esencial para el control de la transcripción de los genes, pero en las últimas décadas se ha revelado que la arquitectura del genoma dentro del núcleo, es decir, en un contexto tridimensional, es importante para el correcto funcionamiento de aquéllos.
Por ello, en los últimos dos años la revista Nature ha puesto especial interés en presentar trabajos sobre si el acomodo del ADN dentro del núcleo de la célula es una consecuencia mecánica del encendido de los genes o si es directamente responsable del encendido y apagado, expuso Arzate-Mejía.
Al respecto, Furlan Magaril precisó que el trabajo ha tenido alto impacto en la comunidad científica internacional porque aporta evidencia para resolver la controversia actual sobre la importancia de los dominios estructurales o TADs en la regulación de la expresión genética, dando evidencia experimental sólida de su relevancia.
Luego de los resultados obtenidos en las líneas celulares de la mosca de la fruta, los especialistas indagan qué ocurre cuando estas alteraciones se producen en un organismo completo y en células humanas. Así, el siguiente objetivo será revisar en líneas celulares de la sangre humana el efecto de encender o apagar al gen Notch, para extrapolarlo al desarrollo de enfermedades como la leucemia.
“Dado que este gen y su función es fundamental para el organismo y se ha conservado durante la evolución, nos interesa comprender si su estructura genómica, así como su regulación, se encuentra también preservada”, concluyó Furlan Magaril.








