Kristi Rosa
El Comité Asesor de Medicamentos Antimicrobianos de la Administración de Drogas y Alimentos de los EE. UU. (FDA) votó 12 a 2 a favor de la seguridad y efectividad de la suspensión de inhalación de liposomas de amicacina (ALIS) para adultos con enfermedad pulmonar micobacteriana no causada por Mycobacterium avium (MAC) que tienen opciones de tratamiento limitadas o ninguna.
Si se aprueba, este tratamiento será la primera y única terapia específicamente indicada para el tratamiento de pacientes con enfermedad pulmonar NTM causada por MAC en los Estados Unidos.
El comité también votó a favor de que el punto final sustituto de la conversión del cultivo de esputo utilizado en el estudio Fase 3 CONVERT sea razonablemente probable para predecir el beneficio clínico, según el anuncio.
«Estamos muy contentos por el resultado de la reunión del comité asesor de hoy, que reconoció el papel que ALIS podría desempeñar para abordar la importante necesidad médica no satisfecha entre pacientes que sufren de enfermedad pulmonar NTM causada por MAC, una crónica, debilitante y potencialmente fatal infección «, dijo en una declaración reciente el presidente y director ejecutivo de Insmed Incorporated, Will Lewis.
El comité basó su recomendación en los materiales desarrollados a partir de la nueva solicitud de medicamentos de la farmacéutica para la terapia, que se presentó bajo las disposiciones de aprobación acelerada. La aplicación incluye datos del estudio CONVERT de fase 3.
Para el ensayo aleatorizado y abierto de fase 3, los investigadores trataron de confirmar los resultados obtenidos de un ensayo de fase 2 completado en 2014. El ensayo incluyó a 336 pacientes y descubrió que la adición de ALIS a la terapia estándar para las infecciones pulmonares causadas por MAC no evidencia de enfermedad pulmonar NTM en el mes 6 para el 29% de los pacientes en comparación con el 9% de los pacientes en terapia estándar sola.
«Los pacientes incluidos en nuestro ensayo clínico de fase 3 representan el segmento más difícil de tratar de la población con enfermedad pulmonar NTM, que ya han suspendido el tratamiento con la terapia actual basada en pautas», agregó Paul Streck, MD, director médico de Insmed. «La recomendación favorable del comité nos acerca un paso más a proporcionar el primer y único tratamiento aprobado por la FDA para estos pacientes».
Sin embargo, de acuerdo con el anuncio, el comité también votó en contra de la seguridad y eficacia de ALIS en la población más amplia de pacientes adultos con enfermedad pulmonar NTM causada por MAC.
La FDA tendrá en cuenta la recomendación del comité cuando decida si aprueba o no la NDA para ALIS que se encuentra actualmente en Revisión de Prioridad. Se estima que la FDA tomará su decisión el 28 de septiembre de 2018.
Anteriormente, a ALIS se le han otorgado medicamentos huérfanos y designaciones de terapias innovadoras. Este medicamento también fue designado como Producto Calificado de Enfermedades Infecciosas bajo la Ley de Generar Inhibidores de Antibióticos Ahora.
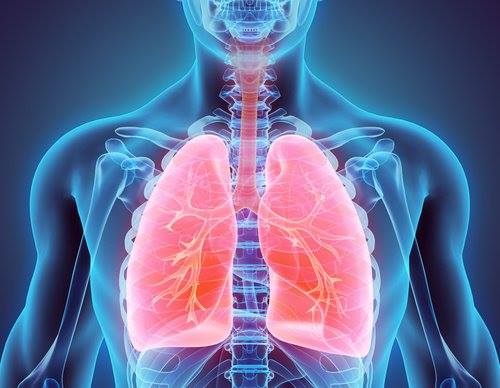
La enfermedad pulmonar NTM es un trastorno raro y grave que se sabe que tiene altas tasas de morbilidad y mortalidad. Se sabe que los pacientes con este raro trastorno experimentan varios síntomas, como fiebre, pérdida de peso, tos, pérdida de apetito, sudores nocturnos, sangre en el esputo y fatiga.
Artículos relacionados: enfermedad pulmonar micobacteriana, enfermedades raras, tratamiento
Fuente: https://goo.gl/eitpxr