El glioblastoma multiforme (GBM) es el tumor cerebral primario más agresivo y frecuente. El carácter altamente invasivo de estos tumores hace que la resección quirúrgica completa sea virtualmente imposible. Esto, sumado a la resistencia de las células de glioma a las terapias convencionales, y al carácter inmunosupresor del micro-entorno del tumor, hace que el tumor recurra y sea letal en la mayoría de los pacientes. Por estas razones, es necesario el desarrollo de estrategias que detecten y erradiquen las células tumorales que invaden el cerebro, sin afectar el tejido no neoplásico que las rodea. Las estrategias inmunoterapéuticas contra el cáncer de cerebro tienen como objetivo la activación específica de células T antitumorales que eliminen las células tumorales residuales presente en el parénquima cerebral tras el tratamiento tradicional, reduciendo así la probabilidad de recurrencias.
Con el objetivo de inducir inmunidad antitumoral en pacientes con GBM, desarrollamos una estrategia de terapia génica que consiste en dos vectores adenovirales (Ads) no replicativos: (i) Ad.TK codifica para la enzima citotóxica condicional, e.g., timidina quinasa, derivada del virus Herpes Simplex 1 (HSV-TK), que, en presencia del pro-fármaco ganciclovir lleva a la apoptosis de células en proliferación. Las células del glioma apoptóticas liberan antígenos tumorales y moléculas proinflamatorias intracelulares, por ej. HMGB1 (Candolfi, 2014 ; Curtin, 2009; Candolfi, 2009); (ii) Ad.Flt3L codifica para la citoquina Flt3L, que induce la expansión y reclutamiento de células dendríticas en el microambiente tumoral (Curtin, 2009; Candolfi 2012), las cuales captan antígenos tumorales, los transportan a los ganglios linfáticos y activan la expansión clonal de linfocitos citotóxicos y de memoria. En estudios preclínicos, este tratamiento induce inmunidad antitumoral adaptativa y regresión de tumores intracraneales en múltiples modelos animales de GBM, promoviendo la supervivencia a largo plazo y la memoria inmunitaria (Candolfi, 2014 ; Curtin, 2009; Ghulam Muhammad, 2009). Esta estrategia está siendo evaluada en un ensayo clínico de fase I en pacientes con GBM, (en la Universidad de Michigan, Departamento de Neurocirugía) que reciben inyecciones de los vectores en la cavidad tumoral tras la resección quirúrgica del tumor (https://clinicaltrials.gov: NCT01811992).
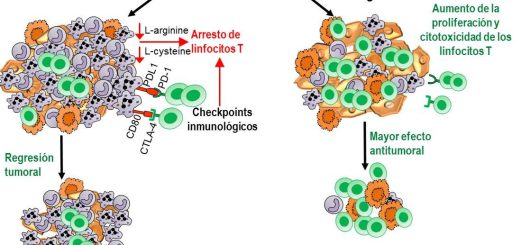
El bloqueo de la inmunosupresión mediada por MDSCs o la inhibición de checkpoints inmunológicos aumenta la eficacia de la terapia génica inmunoestimulante con Ad.TK+Ad.Flt3L. La inyección de Ad.TK seguida de la administración de ganciclovir (GCV) induce apoptosis de células tumorales en proliferación. Las células dendríticas (CDs) son reclutadas al microambiente tumoral (MAT) en respuesta a la inyección de Ad.Flt3L. Después de captar los antígenos tumorales liberados por las células apoptóticas, las CDs los transportan a los ganglios linfáticos para activar una respuesta antitumoral de linfocitos T. Los linfocitos T activados migran al tumor y destruyen a las células tumorales remanentes. En ausencia de MDSCs inmunosupresoras y de señalización por checkpoints inmunológicos se optimiza la activación de linfocitos T citotóxicos antitumorales, mejorando la eficacia de la inmunoterapia génica, aumentando la eficacia antitumoral y la supervivencia a largo plazo.
Si bien existe evidencia de inmunidad antitumoral en pacientes con GBM que reciben inmunoterapia, como por ejemplo vacunas antitumorales, en general esta respuesta es insuficiente para lograr un beneficio clínico significativo. Esto parece deberse a los múltiples mecanismos inmunosupresores que desarrollan el GBM: (i) la expresión de citoquinas inmunosupresoras como TGF-β, VEGF, IL-10 y PGE2; (ii) la presencia de checkpoints inmunológicos, receptores inhibidores de linfocitos T CTLA-4 y PD-1 y sus ligandos (PD-L1), (iii) el reclutamiento de células inmunosupresoras hacia el microambiente tumoral, como las células supresoras de origen mieloide (MDSCs), los linfocitos T reguladores (Tregs) y los macrófagos asociados a tumor (TAMs).
Las MDSCs están implicadas en la escasa respuesta inmunitaria al GBM (Raychaudhuri, 2011; Fujita, 2011). Las MDSCs son una población de células inmunes con actividades inmunosupresoras que juegan un papel importante en la inhibición de la inmunidad antitumoral en varios modelos de cáncer en roedores y también en los cánceres humanos. Estas células inmunosupresoras también han sido descriptas en GBMs humanos (Rodrigues, 2010). Las MDSCs son una población heterogénea de células compuesta por células progenitoras mieloides y células mieloides inmaduras (IMCs). En condiciones normales, las IMCs generadas en la médula ósea (MO) se diferencian en macrófagos, células dendríticas (CDs) o granulocitos maduros. La diferenciación de IMCs en células mieloides maduras parece ser obstaculizada por factores producidos por el tumor, dando como resultado la acumulación de MDSCs, que carecen de los marcadores de superficie normalmente expresados por monocitos, macrófagos o CDs. En ratones, las MDSCs se caracterizan por co-expresar los antígenos de diferenciación del linaje de las células mieloides, Gr1 y CD11b.
Varios grupos, incluyendo el nuestro, han demostrado que la expansión de MDSCs puede ser desencadenada por factores endógenos derivados de tumor, los cuales pueden estimular la mielopoyesis e inhibir la diferenciación a células mieloides maduras. Las MDSCs inhiben la expansión y función de los linfocitos T citotóxicos a través de múltiples mecanismos, que incluyen la producción de factores inmunosupresores como la arginasa y la sintasa de óxido nítrico inducible (iNOS), especies reactivas del nitrógeno y del oxígeno y la producción de IL-10 y expresión de ligandos de “chekpoints” inmunológicos como PD-L1 y CD80.
Con el objeto de mejorar la inmunidad antitumoral inducida por la inmunoterapia, en nuestro reciente artículo publicado en Molecular Therapy evaluamos si el bloqueo de la acumulación de MDSCs en el microambiente tumoral podría mejorar la respuesta a la terapia con Ad.TK y Ad.Flt3L en modelos murinos de GBM. En este trabajo observamos que las MDSCs intratumorales pueden constituir hasta el 80% de los infiltrados inmunes del GBM. El reclutamiento de MDSCs parece depender del perfil genético del tumor ya que los porcentajes de infiltración de MDSCs varían significativamente entre los distintos tumores experimentales. De hecho, ha sido reportado previamente que el ratio de MDSCs vs linfocitos T CD8+ es mayor cuando los tumores experimentales carecen de p53.
Nuestro estudio indica que las MDSCs que infiltran los tumores expresan las moléculas tolerogénicas IL4Ralfa, arginasa, iNOS, PD-L1 y CD80 y son potentes inhibidores de la activación de los linfocitos T. Con el objeto de potenciar la respuesta antitumoral de linfocitos T inducida por el tratamiento con Ad.TK+Ad-Flt3L administramos anticuerpos bloqueantes de Gr-1. Los anticuerpos anti-Gr-1 redujeron el contenido de MDSCs en tumor, bazo y sangre y aumentaron significativamente la respuesta de linfocitos T citotóxicos, anti-tumoralesy la sobrevida de los animales tratados con Ad.TK+Ad.Flt3L. La combinación de la inmunoterapia génica con la administración sistémica de anticuerpos que bloquean la activación de los checkpoints inmunológicos, como anti-CTLA4 y anti-PD-L1, también resultó en un incremento de la supervivencia a largo plazo de los ratones portadores de GBM. Nuestros resultados indican que las MDSCs constituyen un blanco terapéutico critico en el tratamiento del GBM. La depleción de las MDSCs, así como de la neutralización de checkpoints inmunológicos podría mejorar la eficacia de las estrategias inmunoterapéuticas diseñadas para tratar el GBM, como la inmunoterapia génica con Ad.TK+Ad-Flt3L o las vacunas antitumorales de péptidos o de CDs. Dado que la combinación de estrategias que estimulan al sistema inmune con la neutralización de mecanismos inmunosupresores mejora la respuesta antitumoral y que la administración de los anticuerpos bloqueantes de CTLA-4, PD-1 y PD-L1, así como la inmunoterapia con Ad.TK+Ad-Flt3L, se encuentran en evaluación clínica en pacientes con GBM, la combinación de estas estrategias podría ser evaluada en pacientes con GBM para optimizar las respuestas antitumorales.
Artículos relacionados: enfermedades raras, enfermedades poco frecuentes, enfermedades huérfanas, investigación, salud